
400-0355-662
沙特发布了关于MDMA的重大变更和非重大变更指南
近期,沙特阿拉伯食品和药品管理局(SFDA)发布了一则指南“Guidance on MDMA –Significant and Non-Significant Changes”。
●指南目的 ●
该指南的目的是通过举例,阐明在“医疗器械法执行条例”/第(10-8)条和“医疗器械上市许可要求(MDS-REQ1)”/第(5)节中提到的,报告或通知SFDA上市许可医疗器械/用品的重大和非重大变更的要求。该文件适用于已经通过MDMA审批的,并且发生变更的医疗器械产品(包括IVD产品)。
●具体内容 ●
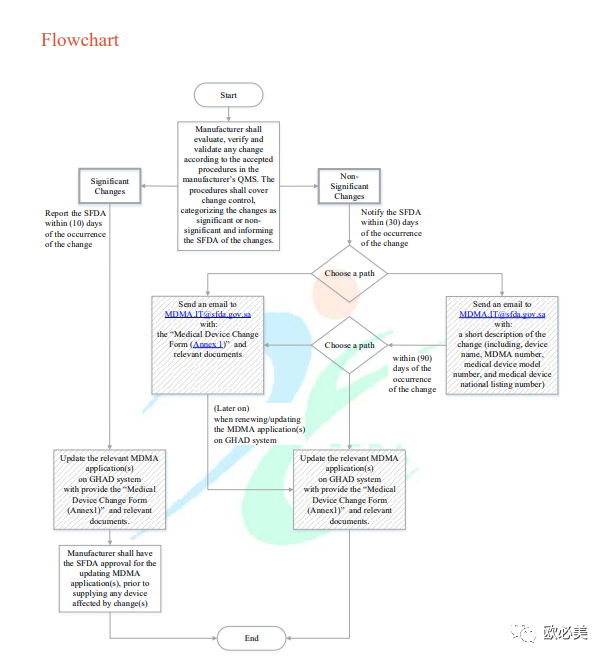
制造商应评估、验证和确认任何变更符合制造商质量管理体系中认可的程序。程序应包括:变更控制;将变更分为重大变更和非重大变更;报告或通知国家食药监局。
A. 其中对于重大变更:

B. 对于非重大变更:

C. 重大和非重大变更的示例:
预期用途和标签变更;关键分包商/供应商变更;质量管理体系变更;制造工艺、设施或设备变更;软件变更;灭菌变更;设计变更;材料变更;安全和/或性能特性变更。
●变更流程图 ●
了解更多关于医疗器械上市许可变更信息可咨询欧必美。
版权所有© 2023 欧必美(青岛)医疗技术有限公司 备案号:XXXX 技术支持:苏州慕名
扫描二维码分享到微信