
400-0355-662
澳大利亚医疗器械认证简介
澳大利亚医疗器械认证简介
1、主管机构和核心法规
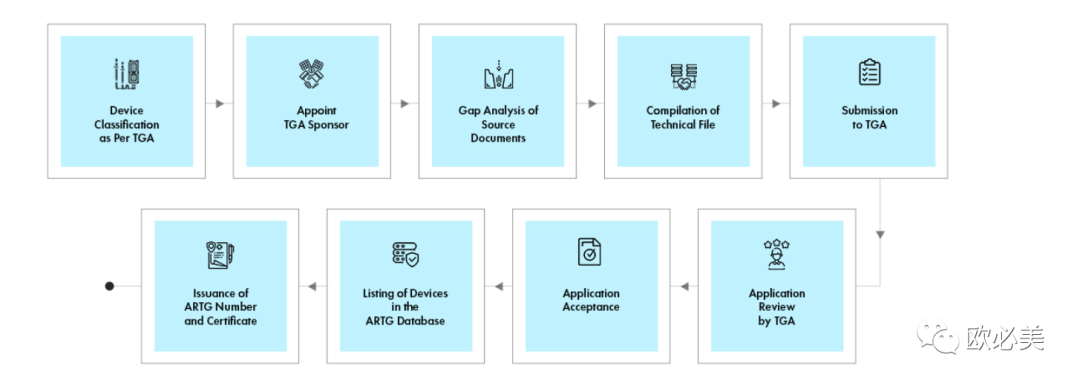
2、产品分类 上述治疗品法案及条例41BD部分阐述了澳大利亚对医疗器械的分类,类似于澳大利亚的分类规则和标准。医疗器械和体外诊断器械有着不同的分类。同欧盟医疗器械CE法规,根据对人体造成可能风险的高低,由低到高,分为四类,即I类、IIa类、IIb类和III类。IVD产品分为1类IVD、2类IVD、3类IVD和4类IVD。 3、注册流程
欧必美服务范围
1) 产品分类
2) 澳大利亚代理Sponsor服务、进口商服务、仓储服务、保险服务
3) 电子商务系统账户创建和管理
4) TGA认证咨询(包括生物学、性能测试等各项测试辅导,技术文档编写,临床研究方案、澳洲临床试验等)
5) 澳大利亚版ISO 13485,MDSAP 认证支持,包括内部审核、模拟审核、培训等
6) 标签审核
7) 上市后监管方案及实施咨询
8) 注册变更
9) 许可证更新和转让
10) 与持证人的联络服务
我们的联系信息:
ABMED MEDICAL TECHNOLOGY PTY LTD
Address: 38 Orma Street Caulfield South VIC 3162
Australian Company Number 666 767 175
DUNS: 750979203
Tel: +61 432 758 222 邮箱:tga@abmed.com.cn
版权所有© 2023 欧必美(青岛)医疗技术有限公司 备案号:XXXX 技术支持:苏州慕名
扫描二维码分享到微信