
400-0355-662
8月25日基于风险管理的医疗器械产品设计验证 培训回顾,精彩连连
前情提要:自2014年在《医疗器械生产质量管理规范》法规的附录中明确定义,设计验证作为设计开发过程中的重要环节,与产品风险管理挂钩,是用来确定产品符合用户需求和预期用途的重要手段,有效降低临床器械不良反应的发生率。
在产品开发过程中,需依照ISO14971(等同YY/T 0316-2016)进行风险管理。

培训回顾:本次郝老师分为三个主题依次来讨论:1,研发过程中的设计验证;2,风险管理在设计验证中的应用;3,医疗器械产品常见设计验证项。
考虑到不同医疗器械产品的巨大差异,目前,所有医疗器械法规对设计开发阶段划分并无具体强制要求,而是由企业依据产品复杂程度、企业状况进行定义。
如设计开发过程瀑布图
(Waterfall Design Process, HC/FDA):
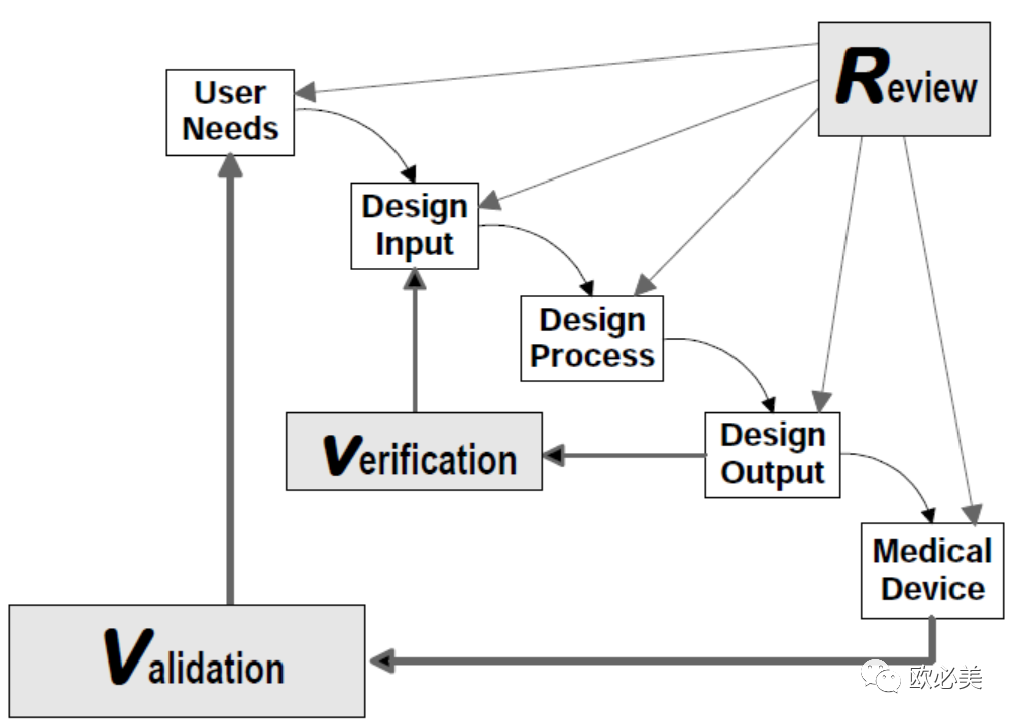
为设计阶段的“设计验证”,是研发流程中核心节点,通常采用试生产(中试)产品实施产品各项性能和功能验证。这些验证报告亦作为产品临床前评价证据。

基于风险分析的结果
设计验证,目的是确保设计开发输出满足输入的要求。验证活动的范围和程度,验证技术的选择,是需要结合产品特性和风险来考虑。
当我们讨论设计验证在实施上的差异,并要求有个如此做的源头时,可认为是风险分析的结果。
总而言之,小欧认为风险管理的核心就是“建体系、知风险、明措施、抓落实、重改进” 。从这五个方面开展工作并形成闭环,建立以风险为驱动的安全生产管理模式,实现部门、专业、单位间围绕风险管控的联动和互动,将风险管控工作理念和行为真正融入到安全生产的每个人、每个环节、每个时段,形成电网、设备、人员的三道防线,确保风险管控人员的在线监督,从根本上保证安全生产的可控、在控。
基于此处,常见工艺确认项目/一些需要确认的常见工序示例:
Sterilization process 灭菌过程
Aseptic filling process 无菌填充过程
Sterile packaging sealing process 无菌包装封口过程等。
常见通用类产品验证项目
1)材料研究
2)产品性能
通常采用型式检验方式,第三方或内部测试。
3)效期验证
通常包括货架寿命、使用寿命等。
如果您对于这块感兴趣,或者其他感兴趣的培训点,都可以来告诉我们,欧必美本着“以人为本”的服务理念,乐于帮助制造商们完成生产的规范以及产品的合格化上市。

欲获免费注册
请扫码填写报名表
版权所有© 2023 欧必美(青岛)医疗技术有限公司 备案号:XXXX 技术支持:苏州慕名
扫描二维码分享到微信